生命编码背后的故事(六十)
冠状病毒
杜德娜和沙尔庞捷在2020年10月初得到她们期待已久的好消息,因为基因编辑技术的贡献携手赢取诺贝尔化学奖。两个月后,沙尔庞捷独自前往瑞典驻德国大使在柏林的府邸领奖。杜德娜则在伯克利的自家后院里从瑞典驻旧金山领事手里接过奖章。11位戴着口罩、保持社交距离的亲友见证这历史一刻。显然,这不是诺贝尔奖的传统颁奖方式。
不到一年前的2019年12月30日,贺建奎在深圳被判刑,为轰动一时的基因编辑婴儿事件划上句号。同一天下午,武汉市一位名叫李文亮的年轻医生在中国流行的社交媒体“微信”上发出消息:当地的“华南水果海鲜市场确诊了7例SARS”。
SARS是“严重急性呼吸道综合症”(Severe Acute Respiratory Syndrome)的英文缩写,在中文里音译为“萨斯”。这个也被称作“非典型肺炎”的传染病17年前在中国爆发,迫使多个城市关闭学校和商场、限制旅行,造成巨大经济损失和数以百计人口的死亡。萨斯这个英文名称因而在中国家喻户晓,十多年后记忆犹新。虽然李文亮的短信只在他很小的同学圈子里出现,这个令人不安的消息还是在小范围内传播开来。
第二天,武汉市卫生健康委员会通报当地发现27个“病毒性肺炎”病例,其中七例病情严重。第三天是2020年的元旦,华南水果海鲜批发市场被市政府关闭。同时,李文亮因为擅自发布未经核实消息先被所在医院领导警告,又在当地派出所接受“训诫”。
但在那个2020年到来的时刻,中国以外的世界风平浪静,只有极少数习惯居安思危的流行病专家在未雨绸缪。美国国立卫生研究院所属疫苗研究中心1的副主任格雷厄姆(Barney Graham)是其中一位。自武汉市卫生健康委员会通报病例属于“病毒性肺炎”后,格雷厄姆便翘首以盼,希望能得知该病毒的具体信息。他与中国疾病预防控制中心主任高福有过私交,但连续几天的联络一直不见回复。
尽管如此,格雷厄姆也已经计划好为这个未知的病毒设计、制作疫苗。他万事俱备,只欠病毒的生命编码。
1796年的一天,英国医生詹纳在他园丁的八岁儿子手臂上划个口子,置入从患有天花病母牛身上刮来的脓。过后,詹纳又故意地让这个孩子与正在被天花病煎熬的其他孩子们密切接触。园丁的儿子异乎寻常地安然无恙。
天花在那个年代是让人谈虎色变的恶性传染病。几乎每个孩子都在劫难逃,迟早会被感染。虽然大部分人能够自我痊愈,也有超过四分之一的患者会因之死亡。另外还有众多患者留下眼盲、皮肤上长满麻子等残疾。“天花”的名称即来自麻子这个常见的后遗症。好在人一辈子中只会经历一次这样的梦魇,一旦痊愈便终身免疫。因此,人们从远古时起已经知道故意让孩子与症状表现相对较轻的天花患者接触,感染后可以避免更为严重的病情。
詹纳不是第一个意识到牛的天花病也可以如此运用的人。在他之前早已有人注意到从小为母牛挤奶的孩子不会得天花病,也已有人尝试以割破孩子皮肤“接种”牛的天花残物的方式求得免疫。但作为一名医生,詹纳在为园丁儿子和其他孩子实验时进行系统、细致的观察并第一个正式发表论文。他因而被认作这一壮举的创始人和免疫学之父。
牛的天花病在中文中叫做“牛痘”,其拉丁文名称“vaccinia”则直接来自“母牛”(vacca)。相应地,用牛天花感染人体的做法叫做“种牛痘”。英文里也有一个来自牛痘的新名称:“疫苗”(vaccine)。随着种牛痘的推广,人类逐渐摆脱这个曾经延续千百年的恐慌。1980年5月8日,世界卫生组织2宣布天花在全球范围消失。那是人类成功灭绝的第一个传染病。
在詹纳之后两个世纪里,后代医生前赴后继,相继发现或发明几十种可以与牛痘相似地植入人体以预防不同传染病的生物制品,为民众减轻甚至解除多种疾苦。它们都被统称为“疫苗”。大规模接种疫苗也成为人类应对传染病的最佳手段。当格雷厄姆在2020年初听到武汉出现新病毒时,科学家对这个行之有效的预防措施的认识已经相当深刻。
1854年,英国医生斯诺在伦敦的霍乱爆发中第一次运用统计方法调查病例发生模式,证明该病的传染途径并非子虚乌有的瘴气,而是当地被污染的井水。30年后,德国医生科赫在霍乱发病区的饮用水中发现致病的细菌,证实斯诺的结论。流行病学随之进入科学时代。其后不久,发现炭疽病和狂犬病疫苗的法国化学家巴斯德又揭示天花和狂犬病与霍乱还不一样。传播这些疾病的不是细菌,而是小得更多的病毒。
细菌早已在17世纪后期列文虎克的显微镜下原形毕露。它们是单细胞的“微小生物”,在人体内利用现成的养分大肆分裂、繁殖,干扰人体的正常运作和功能。它们同时也会释放有害于人体的毒物,即病原体(pathogen),让人得病3。
病毒则要等到1941年才由安德森和卢里亚利用电子显微镜揭露其真面目。它们比细胞小一百来倍,只是一个蛋白质外壳和其中的一小段核酸分子。天花病毒里的核酸是DNA,烟草花叶和脊髓灰质炎病毒内的则是RNA。无论是DNA还是RNA,它们都是病毒生命编码之所在。当然这么简单的病毒无法自我繁殖,不属于独立的生命。它们的攻击方式更为直接:通过与细胞膜上的受体结合将核酸分子注入人体细胞,劫持细胞工厂繁衍自己的“后代”,同时破坏或杀死宿主细胞。因此,病毒本身就是侵蚀人身的病原体。
远在人类出现之前,细菌已经是病毒侵噬的对象。因为这一生死存亡的威胁,细菌进化出独特的免疫机制。而正是通过对噬菌体行为的观察和细菌CRISPR免疫系统的研究,人类学会了基因重组和基因编辑等改写生命编码的技能。
动物和植物更是甫一出现即饱受病毒和细菌的侵袭,也同样地进化出必要的免疫功能。人类属于生命之树末端的高级生物,拥有远比CRISPR更为强大、复杂的免疫系统。在遭遇来路不明的微生物侵袭时,人体会动员起两支不同的防卫部队。
最先反应的是“先天免疫系统”(innate immune system)。它调动人体迅速升高体温、产生大量粘液(mucus)细胞,试图以高温和水淹的物理手段歼灭或阻碍入侵之敌。这是患者发烧和局部出现发炎(inflammation)流脓等症状的原因。这套免疫系统与生俱来,可以广泛地应对任何种类的外敌。只是物理性质的防御方式不具针对性,会同样地祸及自身的健康细胞,经常杀敌一千自损八百。一旦失去控制形成持续高烧或俗称的“炎症风暴”4,就会导致多器官功能衰竭而威胁生命。
更为有效的方法是产生专门对付病原体的抗体,对症下药而不至于伤及无辜。那是“适应性免疫系统”(adaptive immune system)的任务。早在1930年代,年轻的鲍林在德尔布吕克陪同下领悟出抗体与病原体的“互补原理”:如果病原体的外形像是“手掌”,抗体便是为它量身定做的“手套”。二者严丝合缝,形成氢键相连。这也是费舍尔“一把钥匙开一把锁”蛋白质特异性的一个表现。病原体被装上套子后便不再能与它们原本的目标受体结合,从而无法祸害人体。
既然这样的手套需要量身定做,人体必须先知道手掌的外形,即只能在密切接触病原体之后才可能有所反应。因此,在遇见新的病原体时,适应性免疫系统的反应往往不及先天免疫系统迅速,经常姗姗来迟。但好在手套一旦出现就能行之有效地抑制入侵病原体的繁衍,病人也随之痊愈。新出现的抗体在功德圆满之后也不会完全消失,其剩余部分继续在体内随血液循环巡逻。一旦发现同样的病原体卷土重来,它们会立即投入战斗。人体也即刻恢复大规模生产该抗体抵御新一轮的入侵。
当詹纳将牛痘植入园丁儿子的伤口时,牛天花的病毒随之侵入孩子的身体。因为这种病毒危害性不强,孩子的先天免疫系统反应不强烈,没有发烧发炎。但他的适应性免疫系统也已经被激发,产生出针对牛天花病原体的抗体。因为牛和人的天花病毒极为相似,这个抗体手套正好也与人天花病毒的手掌浑然一体。于是,当那个孩子随后接触到人的天花病时,他早已严阵以待的抗体及时发挥作用,让他免受天花病的煎熬。这便是种牛痘以及那之后各种各样疫苗的基本原理。
与细菌直接建立在DNA分子中因而可以代代遗传的CRISPR免疫系统不同,人类的适应性免疫系统是后天经验积累的产物,无法像拉马克、李森科等人所主张地遗传给后代。每一代的新生婴儿还都只能依靠不尽人意的先天免疫系统抵挡各种病原体,在发烧、发炎的历练中重新获取前辈已有的免疫能力。不过作为智慧生物的人类也学会利用疫苗间接地将已经获取的知识传送给下一代,免除他们原本必须经历的苦难和风险。
而当新的疫情爆发时,研制针对性的疫苗更是当务之急。
1918至1922年间,“西班牙流感”的“全球大流行”(pandemic)导致几千万人死亡。其惨烈甚至超越同时期的第一次世界大战。灾难迫使世界各地医生和微生物学家将流感和肺炎作为力求攻克的首要目标。他们逐步发现青霉素、链霉素等各种各样的抗生素,可以有效地协助人体对付细菌的侵袭。但疫苗仍然是应对病毒的首选武器。也正是通过对造成肺炎的细菌——光滑球菌和粗糙球菌——毒性转化的研究,英国的格里菲斯和美国的艾弗里等人确认生命的编码储存在脱氧核糖核酸分子之中,揭开人类认识生命、改造生命的序幕。伴随着生命编码的破解和对生命过程的认识,人类设计疫苗的手段也突飞猛进。
没有证据表明詹纳在园丁儿子身上种植牛痘前曾经得到孩子或他父亲的知情同意。那还是医学实践的蛮荒时代。詹纳的实验十分简单并获得圆满成功,却也不是没有风险。只是那个孩子和詹纳都很幸运。孩子的先天免疫系统没有对牛痘发生过激反应。他的伤口也没有同时感染其它病菌。当然更重要的是,牛痘正好能启动孩子适应性免疫系统产生抗体,为防御人的天花病做好准备。
詹纳之后的免疫学家就没有这么好的运气。人类经受的传染病种类繁多,却没有相应的“牛痘”可供使用。为了同样地在不引发严重病情前提下刺激人体的适应性免疫系统产生抗体,免疫学家只得直接应用危害人类的病毒。他们通过物理的加热和化学的药剂等手段致使病毒失去或减低致病能力,然后将其作为疫苗植入人体。如此制作的疫苗因而叫做“灭活疫苗”。今天的人类已经拥有几十种疫苗,在预防流感、肝炎、肺结核等常见传染病上功效卓著。它们都属于被以各种方式灭过活性的病毒。
然而,将病毒灭活作为疫苗使用同样颇具风险。如果灭活不够充分,制作出的疫苗无异于病毒本身。1955年,美国在大力推行预防俗称小儿麻痹症的脊髓灰质炎疫苗时曾发生重大质量事故。一批未达到灭活标准的疫苗被投入市场,导致80位健康孩子得病。他们之中56人终身瘫痪,五人死亡。显然,人类亟需更为安全可靠的疫苗。
那也正是分子生物学突飞猛进的年代,免疫学家对灭活疫苗原理的理解日渐深入。继噬菌体在电子显微镜下暴露原形后,痛失发现DNA分子结构先机的富兰克林在1958年用X射线衍射技术先后成功解析烟草花叶病毒和脊髓灰质炎病毒的结构。它们的外形大相径庭,但都与噬菌体一样是由一层蛋白质外壳包裹着的核酸分子。这样的构造形同炸弹,外面的弹壳保护着里面真正起作用的炸药。病毒接触到人体细胞时,其外壳上的蛋白质分子以“一把钥匙开一把锁”的方式与细胞膜上的受体蛋白质匹配,骗开大门将其核酸分子注入细胞而达到劫持细胞的目的。被灭活的病毒的外壳或内部核酸分子遭到一定程度的破坏。它们或者不再能够与细胞膜上的受体匹配,或者其受过损伤的生命编码即使进入细胞后也无法复制繁衍,形如哑弹。
同样地,抗体也是通过“一把钥匙开一把锁”方式辨认入侵的病毒并抢先与之匹配,使之失去与细胞膜受体匹配的机会。为达到拦截目的,免疫系统根据病毒特有的外在形状(“手掌”)制造与其互补(“手套”)的抗体。病毒真正的威胁——外壳之内的“炸药”——在这里反倒无关紧要。这是为什么被灭活后已经不具威胁的病毒仍然可能触发免疫反应的原因。因此,最理想的灭活疫苗应该是保持完整蛋白质外壳但没有核酸分子内芯的病毒。就像没有炸药的空包炸弹,这样的疫苗既能触发防御系统又不会造成实质性伤害。无奈人类掌握的灭活方法力所不逮,无法达到这个境界。反倒是灭活的过程常常会破坏病毒原有的外在形状,无法触发合适的抗体。灭活疫苗的研制因而也是困难重重举步维艰。
于是,一个崭新的设想在人类认识生命编码后的20世纪后期应运而生:利用病毒的生命编码人工制造出没有核酸内芯的病毒外壳作为疫苗使用。那即是完美的空包炸弹。
更进一步,疫苗其实也不需要复制病毒的完整外壳。无论是钥匙与锁还是手掌与手套,这些形象的比喻描述的都是两个蛋白质分子之间的形状匹配,并非整个病毒与整个抗体的互补。病毒外壳上总会有一些相对突出的蛋白质作为寻找受体的钥匙或手掌。它们也正是相应抗体寻求的目标。对于人体的适应性免疫系统而言,它们遭遇并试图猎杀的其实不是病毒,只是这类锋芒毕露的蛋白质分子。只要能让这样的蛋白质分子在人体中出现,就能调动免疫系统产生出相应的抗体。这样的疫苗既简单又安全。它们当然不是灭活的病毒,也压根不是任何病毒,只是普通的蛋白质分子,因而不可能劫持人体细胞繁殖自己的后代而造成伤害。
格雷厄姆在2000年来到美国国立卫生研究院新成立的疫苗研究中心时已经从事疫苗研究多年。在这个新的研究中心,他更是二十年如一日孜孜不倦地研究无需灭活病毒的新型疫苗。在他看来,武汉出现的病毒是又一个尝试、检验疫苗新技术的良机。
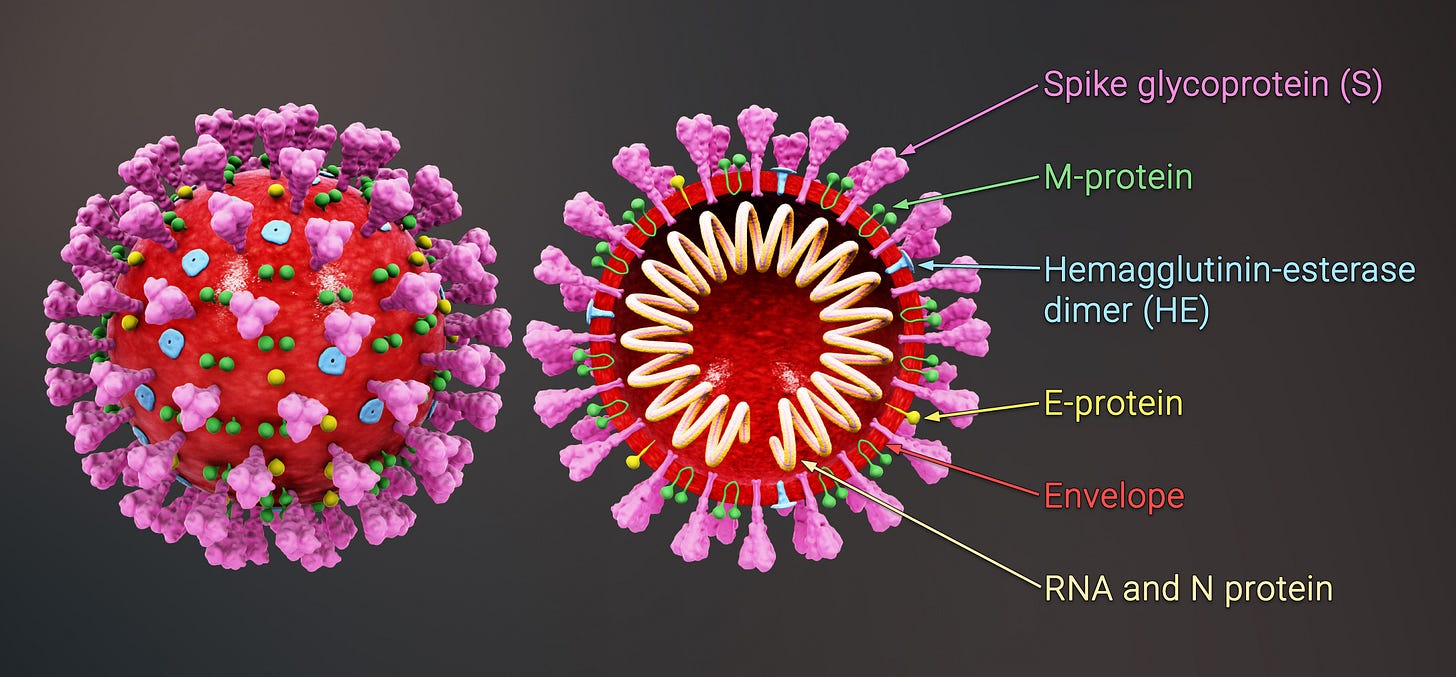
根据多年的经验,格雷厄姆判断在武汉出现的应该是早已熟悉的“冠状病毒”(coronavirus)。这类病毒的蛋白质外壳呈圆球形,上面有很多突出的尖刺,看起来像是一个古代的王冠。但其冠冕堂皇之中包藏着险恶的祸心:病毒的RNA。
那些在球面上张牙舞爪的尖刺形蛋白质分子正是这类病毒的钥匙或手掌,与人类细胞膜上一种名为“ACE2”的蛋白质在外形上相辅相成。二者的衔接让病毒进入人体细胞。冠状病毒主要在呼吸道和肺部繁殖祸害,引发感冒和肺炎。人类认识这类病毒已经有了几十年的历史。它们频繁在动物中流传,造成禽流感、猪流感等家禽家畜流行病。时不时地,它们也以流感的形式在人类群体中传播。因为危害性不大,冠状病毒没有引起过医学界太多的注意力。21世纪初在中国出现的萨斯——严重急性呼吸道综合症——疫情的罪魁祸首也是冠状病毒。虽曾来势汹汹,那次疫情也在一年多内销声匿迹,未能形成全球大流行。武汉新出现的病毒多半也会如此。
不过格雷厄姆对冠状病毒情有独钟。他在研制艾滋病和其它传染病疫苗中屡遭挫折,刚刚选定冠状病毒作为验证新疫苗技术的靶子。武汉的疫情也让他吃惊不小。那里的病例数目和分布表明这次病毒的传播能力超越以往。拥挤不堪的急救室和死亡数字更充分显示其杀伤力。武汉位于中国的中心地带,有着四通八达的公路、铁路和航空系统,不可能将病毒围堵在当地。格雷厄姆和他身边的个别流行病专家隐隐地担心这一次有所不同。整整一个世纪之前的全球大流行可能会重演,后果不堪设想。那样的话,他正在研究的疫苗或许会成为人类摆脱困境的救星。只是时不我待,他必须尽快获取病毒的生命编码。
2020年1月3日,美国疾病预防控制中心主任雷德菲尔德(Robert Redfield)终于与他在中国的对等官员高福通上电话。两人的谈话却不得要领。格雷厄姆和全世界其他传染病专家们还必须继续翘首以待。
也是在那一天,几个来自武汉的小瓶子被紧急送达上海市公共卫生临床中心。复旦大学生物医学研究院的张永振教授早已在那里等候。在那个具备生物医学三级风险防护措施的实验室里,张永振和他的团队成员小心翼翼地从瓶子里取出采自病人呼吸道的样品,从中分离导致疫情的元凶病毒。经过四十个小时的连轴奋战,他们终于在1月5日凌晨两点完成病毒RNA碱基序列的测序。果然,那是一个冠状病毒,与十几年前的萨斯病毒极为相似。
大功告成之后,张永振却陷入意外的困境。他已经在防疫领域浸淫几十年,深知及时发表这个序列——病毒的生命编码——的重要性。然而他的测序结果上报后石沉大海不见天日。在中国境外,只有在澳大利亚工作的英国病毒学家霍尔姆斯(Edward Holmes)知悉张永振已经测得病毒的碱基序列。霍尔姆斯在复旦大学担任客座教授,是张永振的长期合作者和朋友。一天又一天,他五次三番地给张永振发电子邮件、打电话,试图说服张永振公开病毒资料。
58岁的张永振明白中国特有的国情。虽然并没有明文规定不得发表测序结果,他清楚地了解李文亮“擅自”发消息后的境遇。张永振在几个月前痛失爱妻,身心俱疲之下不想招惹个人是非。然兹事体大,在澳大利亚的霍尔姆斯也坚持不懈。
1月11日早晨,张永振刚登上前往北京的飞机时又接到霍尔姆斯的电话。那已经是他完成测序的整整六天之后。张永振终于无力继续拒绝霍尔姆斯锲而不舍的恳求。他在起飞之前给自己实验室打电话,嘱咐那里的人员用电子邮件将病毒测序结果寄送霍尔姆斯。
一小时之内,这些宝贵的数据出现在一个专门收集病毒信息的公开网站上。
美国的东部那时已经是星期五的夜晚。格雷厄姆和他的团队即刻打开文件,审视那一连串由A、C、G、T5四个字符组成的天书。那是病毒完整的生命编码。
那个周末,格雷厄姆的一位研究生使用编辑软件在这些字符串中做了一些似乎微不足道的修改,完成针对该病毒新型疫苗的设计。
这个看起来只是举手之劳的操作凝聚着几代疫苗学家半个多世纪心血的结晶,也将寄托人类战胜冠状病毒的希望。
(待续)
Vaccine Research Center
World Health Organization
也有一些细菌对人体有利。尤其是肠道中帮助消化、吸收食物的细菌,对人类生存至关重要,叫做“益生菌”(probiotics)。
正式名称为“细胞因子风暴”(cytokine storm)。
RNA的编码与DNA不同,其实由A、C、G、U组成。但在数据文件和处理软件里,U通常还是以T代替,与DNA的编码保持一致。