生命编码背后的故事(卅八)
破解编码
RNA领带俱乐部是一个典型的“男孩俱乐部”,20位成员中没有一名女性。俱乐部的乐观者和悲观者都没有想过邀请他们的老相识富兰克林。
富兰克林离开国王学院时净身出户。兰德尔没有允许她带走任何设备、资料甚至朝夕相处的研究生高斯林1,还蛮不讲理地禁止她继续从事DNA研究。在伯纳尔那个小学院里,富兰克林只得从头开始。那里的条件极为简陋,她不得不在实验室里打着大雨伞遮挡楼上透过天花板的漏水。新项目是用X射线衍射研究烟草花叶病毒的结构。那个病毒中只有RNA没有DNA。
沃森曾在卡文迪许实验室里做过这个实验,在看到衍射图案中有螺旋结构的迹象后即知难而退。富兰克林一如既往地踏实认真。她已经大大改进分析X射线衍射数据的帕特森函数方法,与博士后克鲁格(Aaron Klug)一起仅用两年多时间即成功解析出烟草花叶病毒的结构。
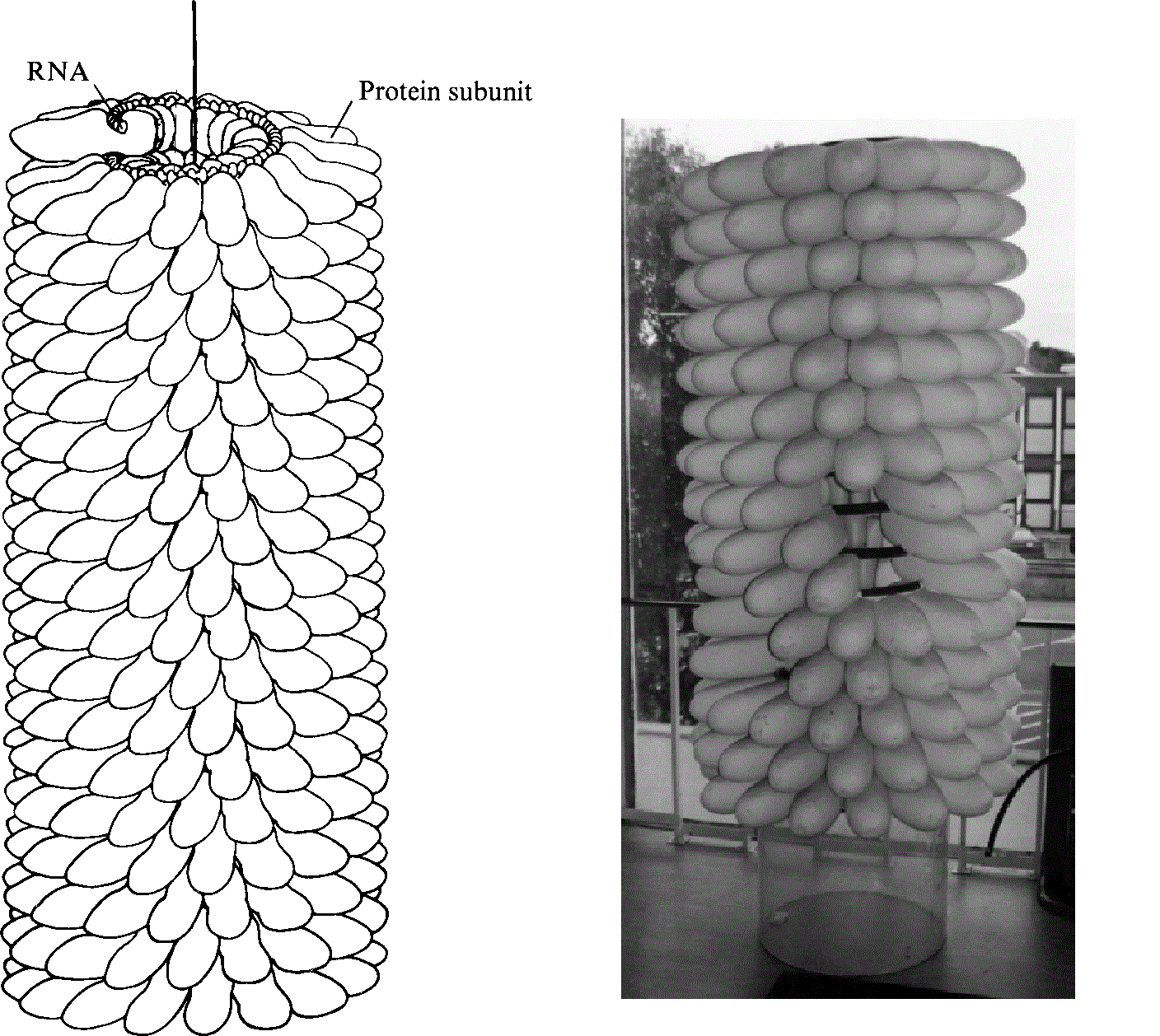
这个病毒与早已在电子显微镜下显露原形的噬菌体完全不一样,整体就像一段螺丝。那其实还是蛋白质肽链折叠而成的外在结构。螺旋的内部才是同样为螺旋形的病毒RNA。已经离开卡文迪许实验室的布拉格看到后大为欣喜,盛情邀请富兰克林制作一个实体模型准备在1958年的世界博览会上展出。
摆脱整天与威尔金斯低头不见抬头见的环境后,“黑暗女士”迅速恢复她活泼热情的性格。富兰克林不再只是独来独往,曾经被她嗤之以鼻的克里克也成为她无话不谈的知己和学术交锋对手。离开国王学院和DNA之后没几年,她已经在病毒结构领域独树一帜。继烟草花叶病毒之后,她和克鲁格再接再厉,又揭示出“脊髓灰质炎”(polio)——俗称“小儿麻痹症”——病毒的结构。这种病毒的外形与噬菌体和烟草花叶病毒又都不同,是一个接近圆球形的二十面体。原本是物理博士的克鲁格在富兰克林的指导和感召下也找到自己的科研道路,后来成就卓著,荣获1982年的诺贝尔化学奖。
1958年初,佩鲁茨亲自来到富兰克林的实验室邀请她加盟科研条件和声望如日中天的剑桥分子生物学实验室。对富兰克林来说,这不仅意味着科学界最权威的认可,更是她重回DNA领域的契机。那是克里克公开发表中心法则不久的岁月,他和桑格等人正在那个实验室紧锣密鼓地试图破解生命的编码。富兰克林欣然接受邀请。然而,她却没能走马上任。
还在那一年前,富兰克林因为腹痛就医时被诊断患有卵巢癌。她没有声张,独自忍受着病魔和放射性治疗的痛苦继续在实验室中全力以赴。只是在两次大手术之后,她都躲到剑桥的克里克家中借住,在奥迪尔的悉心照料下恢复。佩鲁茨来访时,富兰克林正处于乐观的缓解期。但她不久又癌症复发、转移,于1958年4月16日去世。那时,她才37岁。
次日,世界博览会在布鲁塞尔开幕。富兰克林制作的足足一人高的烟草花叶病毒模型最为引人注目。在伦敦,她被安葬于犹太人墓地。墓碑上醒目地标明她的“科学家”身份,并铭刻着死者的功绩:“她的病毒研究和发现仍然在为人类持久造福”2。如同当时的讣告,富兰克林在DNA结构上曾做出的显著贡献没有被提及。
DNA双螺旋结构问世短短几年后,德尔布吕克曾经梦想过的、堪与世纪初时量子物理革命相媲美的生物学黄金时代终于来到了。从基因的自我复制到中心法则的大胆假设,五花八门的理论预测逐步在实验室中得到小心求证。
最早从沃森来信中得知双螺旋结构时,德尔布吕克一边惊叹那是与卢瑟福发现原子核同量级的科学发现,一边也下意识地提出自己的异议。作为生物大分子,DNA的长链相当地长。沃森和克里克提出的自我复制需要那长长、卷曲的双螺旋“拉直”后再解开才能逐个重新组合新的碱基对。还没有完全忘却物理学的德尔布吕克觉得很难想象分子长链能完成如此复杂的运作。它们难免会像毛线般乱成一团甚至打出不可拆解的死结,无法顺利完成复制过程。
这是一个可以实际检验的分歧。在沃森和克里克的机制中,DNA完成复制后的新双螺旋中两条长链有着不同的历史:其中一条来自上一代而另一条则是刚刚组合出的新链。德尔布吕克因而把它叫做“半保留复制”(semi-conservative replication)。他自己则认为分子的长链会先被切成碎片,各自复制后再重新复合成双螺旋。那样复制可以避免彼此纠缠、打结,也不会完整保留原来的旧链。
1957年时,鲍林的学生梅塞尔森(Matthew Meselson)和博士后斯塔尔(Frank Stahl)一起将大肠杆菌DNA中的氮原子置换成稍重的同位素,追踪它们在细胞分裂中的走向。他们证实DNA复制的确如沃森和克里克所预测,令德尔布吕克既震惊又信服。
也许可以想象,在我们身体中那数以万亿计的细胞中也还存在着凤毛麟角的几个特殊细胞。它们之中原封不动地保留着来自受精卵、来自父母的DNA长链。
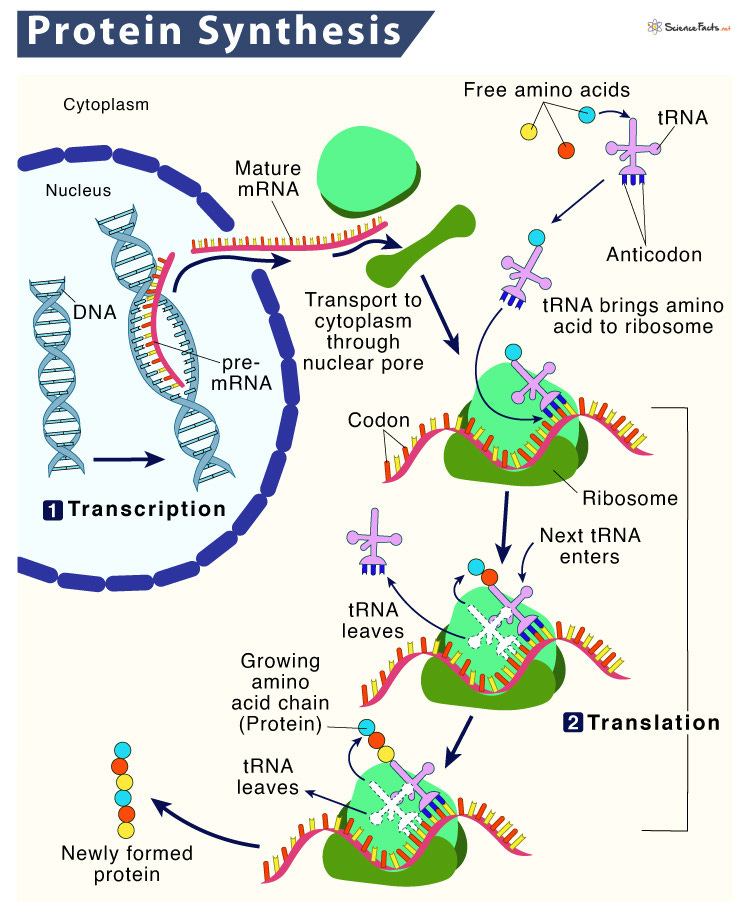
相对于DNA的自我复制,蛋白质的合成更为复杂。生物化学家利用电子显微镜观察到新的蛋白质总是在细胞质里一种叫做“核糖体”(ribosome)的微粒状物资中出现。那里面富含核糖核酸,显示RNA的确是组装蛋白质时必需的媒介。
虎克最先在显微镜下观察到的细胞虽然肉眼不可见,却是一个结构、功能都极为复杂的化学工厂。各种各样的原子、分子在细胞质中川流不息,每时每刻都在同时进行着无以计数的化学反应。为了不受干扰地观察蛋白质的合成,生物化学家学会通过强力研磨破坏酵母、大肠杆菌等细菌的细胞膜,然后用高速离心机分离其中液体,提取适用成分在试管中形成可以模拟细胞工厂的“无细胞系统”(cell-free system)。这是一个可以人为控制、操纵的化学反应环境。他们可以使用试剂或酶排除、鉴定其中各种材料,观察分析各种分子在不同反应中的角色和作用。他们还可以用放射性同位素分门别类地标记氨基酸分子,追踪它们在蛋白质组装过程中的动静和走向。
马萨诸塞总医院的扎梅尼克(Paul Zamecnik)和霍格兰(Mahlon Hoagland)率先发现氨基酸分子在加入蛋白质的肽链前会先依附在一个非常小、从未见识过的RNA分子上。这非常出乎他们的意料,直到听说克里克的大胆假设才恍然大悟:他们发现的正是克里克的适配器分子。这个小小的RNA分子果然有着不同种类,分别对应一种氨基酸——正如克里克的想象。
显然,RNA比DNA更为丰富多彩。它们并非单一的组成和结构。1961年,梅塞尔森在加州理工学院与来访的法国人雅各布(Francois Jacob)和南非人布伦纳(Sydney Brenner)一起从核糖体内又分离出一种RNA。这个分子比那些适配器大得多,像是DNA拆开后的单螺旋长链。已经在哈佛大学任职的沃森与那里的物理学家吉尔伯特(Walter Gilbert)也独立地做出同样的发现。两个彼此熟悉的团队没有争先恐后,约好在《自然》杂志上同时发表各自的论文。
至此,蛋白质的组装过程昭然若揭。那半边DNA似的RNA分子被命名为“信使RNA”(messenger RNA),或直接简称为“mRNA”。正如克里克中心法则所猜想,mRNA在细胞核中由DNA直接“转录”碱基序列而产生。然后,它们像信使一样带着这个编码信息钻出细胞核,来到细胞质的核糖体里作为组装蛋白质的模板。扎梅尼克和霍格兰发现的适配器分子也相应地被称为“转运RNA”(transfer RNA),简称“tRNA”。它们的任务是将mRNA中的编码“翻译”成氨基酸分子。在核糖体中,mRNA长链如计算机中存储数据的纸带般横穿而过。核糖体内的tRNA则相继在mRNA的碱基序列中找到与自己的碱基分子组合互补的地方与之结合。同时,它们“转运”来的氨基酸分子便也同时在另一端连接成肽链,即新的蛋白质分子。
这一切都与克里克的大胆假设分毫不差,只剩下最为关键的问题:碱基分子序列是如何具体地定义蛋白质中的氨基酸的?
1959年夏天,加州理工学院的物理教授费曼走进德尔布吕克的实验室。他早已是这里的常客,但这一次很不同寻常。有一年学术假的费曼不想循惯例去外地访学,要求加入实验室,志愿打一年杂。
刚刚41岁的费曼早已因为创建“量子电动力学”(quantum electrodynamics)声名远扬。3与那个年代很多物理学家一样,他对方兴未艾的分子生物学饶有兴趣,经常与比他小十岁的沃森交流切磋,并在沃森邀请下跻身RNA领带俱乐部。在实验室里,德尔布吕克和梅塞尔森等人将这位知名理论物理学家与新来的生物研究生同样看待,从头开始教他培养噬菌体、研磨细菌制作无细胞系统等基本技术。
那时,他们已经能够通过噬菌体的突变和杂交遗传辨识该突变在DNA长链上的可能位置。那是半个世纪前摩尔根和他的学生们通过果蝇突变辨识基因在染色体上的位置的翻版,只是精细度已经进入分子尺度。费曼孜孜不倦地通过培养皿中细菌被噬食时的不同表现寻觅、观察噬菌体的变异,很快发现一个惊奇:噬菌体在DNA某个位置上的变异经常可以被相距不远的另一个变异“抵消”,让该噬菌体恢复原形。用他熟悉的物理语言来说,基因的变异似乎并不独立。它们像基本粒子一样存在相互作用,影响彼此的功能。实验室里的朋友们起哄地模仿物理学家将这一发现命名为“费子”(Feyntron)。
费曼没能进一步挖掘出“费子”的意义,也没有正式发表论文。在陌生领域中徜徉一年后,他又老老实实地回到自己的本行,埋头研究量子力学与引力结合的难题。
在费曼之后,向来夸夸其谈,专长于理论上大胆假设的克里克也一头扎进实验室,亲自捕捉、解剖小老鼠进行他绝非拿手的生物化学实验。沃森早已离开,克里克也有了新的伙伴:那位来自南非的布伦纳。他俩共用一个办公室,也经常一起去老鹰酒吧吃午饭。布伦纳也是RNA领带俱乐部的成员,他的氨基酸代号是缬氨酸。
生物化学家也已经观察到“费子”,只是他们为之赋予更为正规的名称:“基因内抑制”(intragenic suppression),即某些基因突变可以“抑制”同一个基因中另外的突变。那正是布伦纳感兴趣的课题。核酸中连接碱基序列的共价键不仅能被X射线高能光子打破,也可以在普通的化学反应中被打破重组,从而造成突变。布伦纳发现有几种色素能直接与噬菌体的DNA分子发生反应,诱发不同的突变。但这些突变行为颇为怪异,难以理出头绪。终于有一天在老鹰酒吧午餐时,克里克恍然大悟。布伦纳使用的色素分子颇为奇特,可以在核酸碱基序列中移除单个的碱基对,如同在长长的字母串中擦除一个字母。通过精细地操纵这个化学反应,他们可以控制每次移除的碱基对数目。当一次移除一个或两个碱基对时,噬菌体会发生非常明显的突变。然而,当他们一次性移除三个碱基对时,噬菌体却平静如初,看不出变化。
这个实验确定无疑地证实克里克的编码猜想:DNA中每三个相连的碱基分子对定义着蛋白质中的一个氨基酸。这样的编码序列中如果被移除一个或两个碱基对,后面的全部编码都会随之发生错位,生产出的蛋白质与原来编码的大相径庭。这是所谓的“移码突变”(frameshift mutation)。但如果一次移除的是三个碱基对,那或者正好是抹杀了一个氨基酸或者只是让邻近的两个氨基酸出现差错,但它们后面的氨基酸序列丝毫不为所动。如果出现差错的那一两个氨基酸无关紧要,便看不出噬菌体已经发生了突变。反过来,在碱基系列中添加新的碱基对也有着同样的效果。
费曼最先观察到的“基因内抑制”也是移码突变的一种表现。当一个突变是在碱基系列中添加或移除一个碱基对,而另一个与之相距不远的突变正好又是移除或添加一个碱基对时,它们造成的差错只局限于两个突变点之间的编码。那两个突变的效果在它们之后的序列中完全抵消,因而被“抑制”。
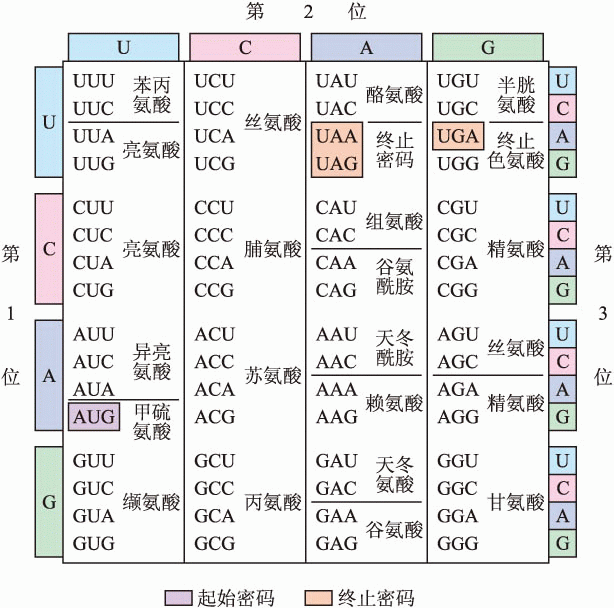
于是,蛋白质的氨基酸由核酸中三个碱基对——或三个字母——组合定义。这样的三个碱基对组合因而被称之为生命信息的“密码子”(codon)。作为适配器的tRNA也有着三个与之互补的碱基组合,即“反密码子”(anti-codon)。通过反密码子与密码子的互补结合,tRNA可以将这个密码翻译成它所携带的氨基酸。
在那个振奋人心的1961年之夏,第五届国际生物化学大会在莫斯科大学隆重开幕。第二次世界大战结束之后,社会主义阵营的苏联及其东欧盟国与西方世界被所谓的“铁幕”隔离。李森科得势后的苏联生物学界尤其遭受摧毁性打击,已经与西方完全脱钩。但随着斯大林在1953年去世,李森科的铁腕控制开始没落,出现了在莫斯科举办这个国际会议的可能。这个几十年来绝无仅有的机会吸引了好奇的西方生物化学家。他们蜂拥而至。报名人数很快超过5000,远远多于以往的规模。正在谋划东山再起的李森科没有在会议中露面,也完全回避专程去参观他的实验室的西方同行。受邀协助组织、安排日程的佩鲁茨则惊讶地发现“分子生物学”这个名称在苏联还不存在,也不被允许出现。
大会的重头讲演在几个宽敞豪华的大会堂里进行,与会者趋之若鹜。与之形成鲜明对照的是遍布校园的几十个分会场,那里名不见经传的小人物只能面对稀稀落落的听众做15分钟的简短报告。梅塞尔森有次碰巧走进这样的一个小教室,听到一位名叫尼伦伯格(Marshall Nirenberg)的美国人介绍自己刚刚完成的实验。寥寥无几的听众毫无反响,梅塞尔森却暗自大吃一惊。他找到克里克和佩鲁茨,请求他们让尼伦伯格在大讲堂里再来一遍。
佩鲁茨立即安排三十出头、默默无闻的尼伦伯格在会议最后一天的主会场上重复讲解。这一次,全场几千名听众在震惊中欢声雷动。
在那个1960年代初,破解DNA和RNA中的碱基编码既已触手可及又困难重重。已经成功完成蛋白质中氨基酸测序的桑格正想方设法如法炮制,通过测定核酸中的碱基序列破解编码。梅塞尔森、布伦纳和克里克等人也都在全力以赴。但在美国国立卫生研究院工作的尼伦伯格和合作者马泰伊(J. Heinrich Matthaei)却反其道而行之。他们利用的是已经知道碱基序列的人造RNA分子。
生物化学家早已学会在试管中利用酶合成简单的RNA分子。当他们只提供单一的碱基分子作为材料时,合成的RNA长链中就只有那一种碱基。比如,如此而来的“多聚尿嘧啶”(poly-U)中只含有尿嘧啶,其碱基序列一目了然:“UUUUUUU……”。
这个简单重复的分子正是薛定谔曾经不屑一顾的“周期性晶体”,不可能存储真正的编码信息。当尼伦伯格和马泰伊将这个无聊的分子加入制备好的无细胞系统时,他们通过放射性同位素的示踪发现只有苯丙氨酸在响应,组装成只含有这一种氨基酸的“多聚苯丙氨酸”:一个人造的多肽“蛋白质”。凭借这么一个别出心裁的小实验,他们破解了RNA碱基序列的第一个密码子:“UUU”定义的是苯丙氨酸。
因为DNA中的编码与RNA一致,只是RNA中的尿嘧啶(U)在DNA中是胸腺嘧啶(T),DNA中相应定义苯丙氨酸的便是“TTT”。
在去莫斯科之前,尼伦伯格曾经申请参加久负盛名的冷泉港学术会议,因为没有名气被拒。幸亏梅塞尔森的不期而遇,他才有了在莫斯科会场上一鸣惊人的机会。而在那同时,留在美国的马泰伊又已经用“多聚腺嘌呤”(poly-A)和“多聚胞嘧啶”(poly-C)完成了同样的实验,破解另两个相似的密码子:“AAA”和“CCC”分别对应于赖氨酸(lysine)和脯氨酸(proline)4。
在破解这三个密码子的同时,尼伦伯格和马泰伊的实验还为破解RNA碱基编码另辟出蹊径。接下来的几年里,他们在美国国立卫生研究院与世界各地的生物化学实验室展开激烈竞赛,通过人工合成比单一碱基更为复杂的RNA分子逐渐辨识出越来越多的密码子。短短五年之后,三个碱基不同组合的64个密码子被全部破解。
但这并不是克里克曾引以为傲的“无逗号编码”。还在莫斯科听到尼伦伯格的轰动新闻之前,克里克已经认识到那个自然优美地定义20种氨基酸的机制其实不切实际。而尼伦伯格和马泰伊最先破解的“UUU”也正是“无逗号编码”认定的“无意义”组合,却十分有意义地定义着苯丙氨酸。事实上,生命的编码并没有排斥重复定义的“简并”:几乎每一种氨基酸都由不止一个密码子重复定义着。大多数氨基酸有两个或四个密码子定义。亮氨酸(leucine)独占鳌头,拥有六个不同的密码子定义。
不过核酸中的碱基编码也确实没有“逗号”。为了避免错位,每个蛋白质的定义序列都有一个共同的“起始符”:定义甲硫氨酸(methionine)的“AUG”。tRNA分子就是从“AUG”开始与mRNA长链上的碱基序列逐次连接组装蛋白质。这个过程相当于每三个字母一组地阅读编码,中间没有重叠、跳跃。同样地,蛋白质编码中也有“终止符”:“UAA”“UAG”或者定义色氨酸(tryptophan)5的“UGA”。当它们中的一个出现在mRNA序列中时,正在进行中的蛋白质组装即大功告成。
在这样的编码中,每一个碱基分子(字母)都可能具备决定性意义。如果因为自发或外来干扰,RNA中一个腺嘌呤被替换成尿嘧啶,而这个碱基分子所处的位置又正好是定义血红蛋白第六个氨基酸的中间字母,使得那里的“GAG”变异为“GUG”(或者相应地,DNA中的“GAG”变成“GTG”),这“一字之差”就会造成血红蛋白的氨基酸序列中谷氨酸被置换成缬氨酸而导致镰状细胞贫血症,为成千上万的人带来无尽的痛苦和死亡威胁。
在1960年代,自达尔文、孟德尔而始的现代遗传研究进入一个崭新的时代。人类认识了主宰生命的编码。
(待续)
富兰克林离开后,高斯林的导师又重新换回为威尔金斯。他在1954年博士毕业后转向医学,远离DNA是非之地。
Her research and discoveries on viruses remain of lasting benefit to mankind
沃森在RNA领带俱乐部中的氨基酸代号。
德尔布吕克在RNA领带俱乐部中的氨基酸代号。