量子纠缠背后的故事(之八)
卢瑟福的原子
1905年2月,当瑞士专利局的爱因斯坦开始陆续寄出他那几篇划时代的论文时,19岁的玻尔是哥本哈根大学二年级学生。他参加了一次全国性竞赛,赢得金奖。
丹麦也是一个偏僻所在,全国只有那一所正规的大学。玻尔的父亲是学校里很有名气的生理学教授,曾两次获得诺贝尔医学奖的提名。玻尔的母亲则是大家闺秀,她父亲是当地显赫的银行家、政客。他们的家庭属于丹麦最富裕阶层。玻尔从小在仆人、保姆簇拥的环境中长大,也频繁受到父亲众多知识界朋友的思想影响。
丹麦科学院每年组织一次大学生竞赛。那年的物理考题是根据瑞利男爵早年的一个设想测量液体的表面张力。玻尔得天独厚,利用父亲实验室的条件设计、进行了实验,赢得金质奖章。他所作的论文颇有价值,得以在英国的学术杂志上正式发表。
这个经历让他喜欢上了物理,毕业后继续在学校里唯一的物理教授指导下继续攻读硕士、博士学位。他博士论文的答辩时间之短创了历史记录,因为他导师承认整个丹麦还没有人——包括他自己——懂得玻尔所作的课题。
出于地理渊源,丹麦的优秀学子传统上会去德国留学镀金。玻尔的父亲当年是在莱比锡大学获得学位,弟弟也已经去了哥廷根大学。玻尔博士毕业时,他父亲不幸英年早逝,但已经帮助他获取了一项由嘉士伯啤酒公司——丹麦绝无仅有的国际级骄傲——提供的奖学金,可以出国游学一年。
玻尔选择的却是英国的剑桥。那里曾经有过牛顿和麦克斯韦,是物理学的圣地。那里还有他崇拜的汤姆森,现代电子理论的泰斗。
1911年9月,26岁的玻尔走进了已经大名鼎鼎的卡文迪许实验室。
他那篇在丹麦没人能懂的博士论文研究的是金属中的电子,分析了汤姆森、德鲁德、洛伦兹等人的理论及缺陷。他抵达后的第一件事便是抱着特意找人翻译成英文的博士论文去拜访汤姆森,用结结巴巴的英语介绍了自己的工作,并特意指着其中一页说:这里我发现了你的一个错误。
汤姆森那时已经55岁,不再年轻。他对这个外来小青年的唐突不以为忤,客气地收下了论文,许诺会抽时间阅读。
慕名而来的玻尔不知道汤姆森这时已经移情别恋。除了还专注于发展他的原子模型,汤姆森的注意力早从阴极射线的电子转向阳极射线——阴极射线管中反方向射出的带正电的离子。玻尔也被安排做这方面的实验,但他兴趣缺缺,还是用更多的时间琢磨他的电子理论。
时间在很快地流逝。他刚到时的兴奋没有能延续多久,因为他看到自己那篇论文在汤姆森堆满文件的桌子上积累灰尘,没有被翻动过。他也发现汤姆森整天忙于事务而无暇科研。那实验室也跟他一样有着一种英国绅士般的老气横秋。
玻尔的父亲虽然是德国大学出身,却对英国的文化一往情深,在剑桥很有一些学生、朋友。他们热情地接待了这个故友的孩子,让年轻的玻尔宾至如归。他在那里社交生活颇为丰富,还参加了当地的足球队。他同时也热衷于旁听汤姆森、金斯等人的物理课程,广泛阅读物理文献和英国文学著作。让他颇为烦恼的是他的英文还是太差,加上言语木纳的性格,他很难与人交流,尤其是他所尊敬的汤姆森。
11月初的一天,玻尔前往曼切斯特大学拜访那里一位曾经是他父亲学生的生理学教授。刚刚从索尔维会议回来的卢瑟福恰好过来串门。卢瑟福与这个不期而遇的小伙子一见如故,以他特有的大嗓门竹筒倒豆子般地介绍了他在会议上听到的新鲜、神奇的量子理论。
年底,卢瑟福作为老校友又回到卡文迪许,在晚宴上与年轻人打成一片。正处于事业巅峰的卢瑟福朝气蓬勃神采飞扬,在玻尔的眼里正是稳重、内敛的汤姆森之反面。很快,玻尔取得卢瑟福和汤姆森的同意,几个月后离开卡文迪许,转往曼切斯特学习新潮的放射性。
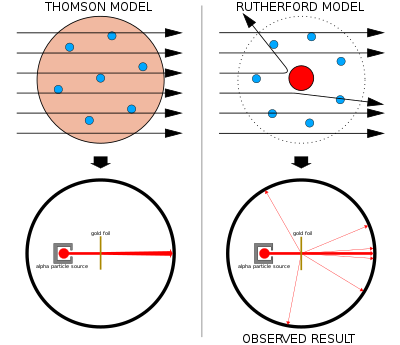
曼切斯特是随着工业革命崛起的蓝领重镇。那里为数不多的知识界人士也时常聚会交流科学问题。在卢瑟福去索尔维会议半年前的一次大会上,一个商人绘声绘色地回顾他如何在进口的香蕉包装中发现了蛇的一个新品种,得意洋洋地让听众传看了那条蛇。接下来发言的是卢瑟福。他没有什么可以展示,只能形象地描述:原子不是一个均匀的布丁,而是空空荡荡,中间有一个极小极小的核:“就像这么个大讲堂中间的一只苍蝇”。
通过α粒子的散射,卢瑟福和他的助手、学生们正在逐步认识原子的可能结构。他推断原子之中必须有一个带正电而质量高度集中的核,才会有足够的排斥力和动量将粒子反弹回来。所以,与汤姆森的布丁相反,他提出原子是由这么一个“原子核”和它外面的电子组成。原子核与电子之间与演讲大厅一样空空如也,因此绝大多数α粒子可以通行无阻。少量的粒子因为接近原子核被散射会偏离方向。只有极少数的倒霉蛋迎头撞上原子核被弹回。
这个新的电子模型相当争气。卢瑟福据此计算出的散射结果与盖革等人测量的数据完全一致。原子核的存在因而可以确定无疑。
令他头疼的是原子核之外的电子。汤姆森的布丁将电子镶嵌在均匀分布的正电荷中间,可以达到平衡。卢瑟福把带负电的电子与带正电的原子核分开了,它们之间的吸引力会立刻让它们加速靠近而合并。当然,物理学家早就熟悉这个问题:太阳与行星之间存在万有引力,但行星可以通过围绕太阳公转而形成稳定的平衡态。电荷作用力与万有引力有着相同的数学形式,因此电子也可以有同样的轨道运动。早在卢瑟福提出原子核概念之前,就有人设想过一个类似土星环形状的原子模型。
然而,电磁相互作用却有着特殊的麻烦。如果电子在运动,就会按照麦克斯韦的理论发射电磁波而消耗能量。这样,电子的速度会越来越慢,轨道半径越来越小,很快会坠入原子核而不复存在。1
于是,电子无论是静止还是运动,卢瑟福都无法自圆其说。他的新原子模型不稳定、不可能存在,也就无法被物理学界接受。在随后的索尔维会议上,没有人提及他这个模型。
玻尔直到1912年4月才得以离开卡文迪许,搬到曼切斯特。他那一年的奖学金只剩下了四个月。虽然急于出成果,他在新实验室的生活也没有太多改变。白天,他上着一门由盖革等人教授的放射性测量基础课。晚上,他依然兢兢业业地琢磨他的金属电子理论问题。不过,受新环境的影响,他的注意力逐渐转向了放射性和原子问题。
卢瑟福之“接收”玻尔很令人不解。他不仅轻视物理学之外的科学,还尤其看不上理论物理学家。而玻尔显然更倾向于理论研究。但卢瑟福依然对他另眼相看:“玻尔不一样,他是踢足球的。”2
玻尔的“不一样”很快就有了表现。他了解到卢瑟福、索迪等已经发现了多种多样的放射性元素,却很难合适地分门归类。因为它们中有许多互相之间非常相似,无法用化学方法分离。
道尔顿提出原子论时,区分不同原子的物理性质只有一个:原子量,也就是原子的重量。俄国的门捷列夫(Dmitri Mendeleev)后来发现元素的化学性质有一定的规律,制作出了元素周期表。表中的元素也是以原子量的大小排列,原子量不同的原子属于不同的元素。
玻尔在分析了新的数据后提出那些无法分离的其实是同一种元素,只是原子量不同。他认为元素的辨别不是原子量,而是其电子的数目。或相应地,原子核所带正电荷的数量。他兴冲冲地找卢瑟福报告,认为这是一个可以证明他那个原子模型的证据。卢瑟福却没有附和,告诫年轻的玻尔要谨慎,不能随意由不充足的实验数据做大结论。3
玻尔颇为自信。但在碰了几次壁后,不善言辞的他害怕惹恼了卢瑟福只好放弃了。
一年后,索迪独立地提出了同样的思想。因为不同原子量的原子可以属于同一个元素,在周期表中占据同一个位置,这个新概念叫做“同位素(isotope)”。周期表中的元素则改为由电子数目——“原子序数”——排列4。改写了元素周期表的索迪后来以此赢得诺贝尔化学奖。
玻尔没有气馁,对卢瑟福反而更为敬重。
卢瑟福的实验室里也还有着一位做理论的年轻人。他比玻尔还小两岁,有着一个显赫的大名:达尔文(Charles Galton Darwin)——进化论鼻祖、“真正的”达尔文(Charles Darwin)的孙子。他当时正在研究α粒子实验的另一面。
卢瑟福自己最关注的是那些被原子核散射、弹回的极少数粒子。他只需要考虑粒子与原子核的相互作用,原子核之外的电子可以忽略不计。达尔文则相反。他关心那绝大多数没有被散射、直线穿透金箔的粒子。它们穿越了原子中间的虚空,但不可避免地会受到外围电子的影响。他希望能通过这些粒子的能量损失来探测那些电子的分布。因为它们的路径离原子核比较远,这时可以忽略原子核的作用。
玻尔看到论文后立即就意识到达尔文的方法有漏洞。他向卢瑟福提出可以做一个更全面的研究,同时兼顾原子核和电子的作用,一并计算它们对α粒子的总体效应。他觉得这个问题不复杂,几天功夫就能完成。卢瑟福这次非常鼓励,特准他不用去实验室上班,专心在家做理论。
正是在这个时候玻尔才发现卢瑟福的新原子模型之根本不可能:他没法设计出一个稳定的原子核与电子和平共处的结构,也就无从计算它们共同对α粒子的作用。这显然不是一个几天之内能解决的问题。而他的时间也到期了。
1912年8月1日,玻尔在哥本哈根市政厅与等了他一年的女友玛格丽特(Margrethe Norlund)成婚,只花了两分钟完成手续。他这时已经摒弃宗教,正式退出了教会,也就没有举办传统的教堂婚礼。
他们原定于去挪威度蜜月。但玻尔临时变卦,拽着新娘子去了曼切斯特。在那里,他花了两个星期终于与卢瑟福完成α粒子吸收、散射论文的定稿。玻尔并不满意。那只是对达尔文工作的一点改进。在论文最后,他预告很快会另外发表专门探讨原子结构的新论文。在给卢瑟福留下一篇简短的笔记之后,他才与新婚妻子去苏格兰欢度剩下的两星期蜜月。
回到丹麦的玻尔虽然没有像爱因斯坦当年那样在职场处处碰壁,他的处境其实也强不了多少。那里的学术职务稀少,没有空缺。他只能在小学院里代课教授初级课程。在与卢瑟福的通信中,他不时抱怨没有时间继续研究原子结构,为不断的拖延道歉。
在离开曼切斯特之前,玻尔在原子结构上的确已经有了新的想法。在用太阳系作为原子的类比时,他发现一个不那么显然的区别:原子有一定的大小。
太阳系——或任何类似天体系统——中各个行星的轨道位置是随机的,来自最初形成时物质碰巧的分布。在太阳的引力场中,行星、彗星等的轨道可大可小。整个太阳系也就没有预先设定的大小。
当卢瑟福确定原子核的大小只是大会堂中一只苍蝇那么微不足道时,原子的大小只能由外围电子的轨道半径决定。然而,与万有引力类似,电荷作用只涉及到质量和电荷两个参数,它们无论如何组合不出一个长度单位。于是,电子与行星一样,轨道可以是任意的大小。如果现实中的原子有确定的尺寸,那必然来自电磁理论之外的物理规律。
这不是玻尔第一次发现经典理论的不完备。早在他那篇没人读过的博士论文中,他就曾提到传统的电子理论无法完全解释金属的导电、导热及磁性现象。但这时,他对新物理规律的来源已经有了更明确的认识。卢瑟福转述的索尔维会议见闻给他留下过深刻的印象:当经典理论走投无路时,只能打破旧的桎梏,像普朗克、爱因斯坦那样引进全新的规则——哪怕这新规则多么地不可思议。
普朗克引进的新规则是能量子的能量与频率成正比,二者之间的系数已经被称为普朗克常数。当玻尔把这个常数与原有的质量、电荷一起组合时,发现果然能够凑出一个长度单位。而且,这个长度与已知的原子大小非常接近。他非常兴奋:电子的轨道大小不随意,是由新的量子规律决定。5
也是在这时,玻尔突然在文献中发现已经有一篇用同样的办法设计电子轨道的论文,作者是他认识的尼科尔森(John Nicholson)。并且,尼科尔森还更进了一步,将电子轨道运动的角动量与普朗克常数联系,认为只有角动量是普朗克常数整数倍的极少数轨道才是可行的6。他把这个模型套用在天文观测中发现的日冕光谱上,似乎挺合拍。
尼科尔森是玻尔在卡文迪许实验室见到的众多年轻人之一。他比玻尔只大四岁,这时已经成为伦敦国王学院的数学教授。他也是在研究了索尔维会议的纪要之后提出了这个将电子轨道“量子化”的建议。他的论文发表在英国天文学会的月刊上,在物理学界没人注意。半年之后才被玻尔发现。玻尔大为惊愕。他印象中的尼科尔森的学术能力不堪恭维,没想到会突然有此一举。好在除了电子轨道这个要点,那篇论文的出发点和逻辑都相当混乱,没有可取之处。玻尔庆幸他还没有失去机会,正好可以从中去粗取精,继续构造自己更合理的原子模型。
尼科尔森的论文还给了玻尔另一个启示。能探究原子内部结构的不只是α粒子散射,还有现成的光谱数据。后者其实更为重要。
更迫切地,玻尔意识到还会有更多、比尼科尔森更强的人正在争分夺秒地研究原子的结构,随时都可能有重大突破。时不我待。
(待续)
其实,公转着的行星也同样会因为发射引力波而失去轨道稳定性,但那时引力波概念尚未出现。当然,引力波极其微弱,可以忽略不计。参阅《捕捉引力波背后的故事(之六):“外星人”来电中的引力波》。
大学期间,玻尔和弟弟都是当地有名的足球明星。玻尔是守门员。他后来成为数学家的弟弟是前锋,曾作为国家队员代表丹麦在1908年奥运会上赢得银牌。40年后,玻尔以卢瑟福命名的小儿子作为曲棍球员也代表丹麦参加了奥运会。
毕竟,原子中的电子数目在那时还没有定论。汤姆森最初曾设想原子的质量来自电子,因此每一个原子都会有几千个电子。卢瑟福的散射实验否定了这个推测,逐渐确定原子的电子数目大致是原子量的一半。
有意思的是,最早提出原子序数概念的是一个业余物理爱好者,荷兰的律师Antonius van den Broek。
他所用的以物理量的单位发现物理性质的方法叫做“量纲分析”(dimensional analysis)。
严格来说,是普朗克常数除以两倍圆周率的整数。